|
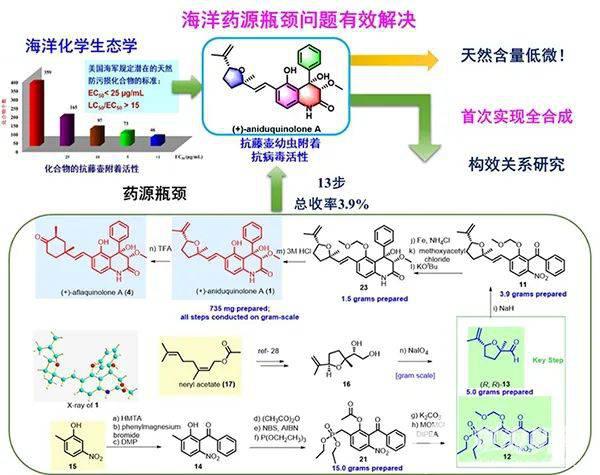
(+)-Aniduquinolone A全合成路线及一步酸催化转变成aflaquinolones 2022年3月17日,中国海洋大学医药学院、海洋药物教育部重点实验室邵长伦教授团队,首次完成了抗病毒活性海洋天然产物(+)-aniduquinolone A 的全合成并实现其规模化制备,相关研究成果以“Scalable total synthesis of (+)-aniduquinolone A and its acid-catalyzed rearrangement to aflaquinolones”(《(+)-aniduquinolone A 的规模化全合成及其酸催化重排成aflaquinolones》)为题发表在Nature系列期刊Communications Chemistry(《通讯化学》)上。 研究团队前期从一株珊瑚来源真菌Scopulariopsis sp.中分离获得两个喹啉酮生物碱(+)-scopuquinolone A和(+)-aniduquinolone A,显示出极强的抗藤壶幼虫附着活性,达皮摩尔级(Shao, et al, Mar. Biotechnol., 2015, 17, 408)。构效关系研究发现,侧链中的四氢呋喃和环己酮环系是其关键药效基团。该系列化合物还表现出显著的选择性抗单纯疱疹Ⅰ型病毒(HSV-1)活性,IC50分别为68 nM和160 nM(安全指数分别为955和898),具有极大的开发潜力(邵长伦等,美国授权发明专利,US10639303B2)。然而,该类化合物天然含量低,样品难以大量获取,极大限制了其作为候选药物的开发应用。 针对(+)-aniduquinolone A的结构特点,研究团队发展了新的全合成策略,采用高E构型选择性的Horner-Wadsworth-Emmons (HWE)反应,首次实现了喹啉酮片段与呋喃单萜片段的高效连接,同时运用高非对映选择性的分子内Aldol反应构建了喹啉酮片段。最终,从2-甲基-5-硝基苯酚出发,经过13步,以总收率3.9%,成功实现了(+)-aniduquinolone A的全合成,并达到克级规模制备,为后续创新药物研发奠定了重要基础。研究人员同时发现,在上述合成策略实施过程中,仅需将(+)-aniduquinolone A用三氟乙酸处理,即可一步完成另外一类新颖结构天然产物aflaquinolones的高效转变。这为aflaquinolones类天然产物的生物合成途径提供了新思路,也为该类化合物的规模化制备和药物研发提供了重要保障。 围绕上述系列海洋天然产物,邵长伦团队开展了从发现到高效全合成以解决药源问题的系统研究工作,先后获授权中国发明专利2件和美国发明专利3件,为该类抗病毒活性海洋天然产物的药物开发与利用提供了物质保障,也为我国“蓝色药库”开发计划提供了重要的具有自主知识产权的实体分子。 中国海洋大学作为独立通讯单位,邵长伦教授为通讯作者,医药学院博士生郭凤伟和牟晓凤博士为共同第一作者,王长云教授、顾玉诚教授、魏美燕副教授和硕士生曲勇等为共同作者。相关工作得到国家优秀青年基金、海洋试点国家实验室鳌山人才、中央高校基本科研业务费、泰山学者青年专家和先正达博士生奖学金等项目的资助。 文章链接: . z% [- Q; W \ d& q: a
|