|
+ I6 }1 G1 K; d' F
原标题:海洋多肽的提取纯化及生物活性研究进展 $ S' ?, z0 G" \- y+ t
摘要:海洋生物是人类重要的食物来源,其中含有大量高质量的蛋白质。海洋多肽具有抗高血压、抗氧化、抗肿瘤等生物学功能,作为开发功能性食品和药品的来源具有巨大的潜力。本文介绍了近年来国内外利用化学水解法、酶水解法、微生物发酵法以及物理辅助提取法提取海洋多肽并采用色谱法、膜分离法将其分离纯化的相关技术,比较了它们之间的差异性,并对海洋多肽的血管紧张素转换酶(ACE)抑制活性、抗氧化活性和抗肿瘤活性等生物活性以及应用现状进行了综述。
" ?4 O, s8 g9 U9 t( L1 l" S 蛋白质是生命活动的物质基础,是构成细胞内生命物质的主要有机成分。人体摄入的蛋白质经消化道中的酶作用后,大多数以寡肽的形式被消化吸收。生物活性肽是具有生物活性的寡肽,自1902年第一种多肽类物质促胰液素被发现以来,人类对多肽的认识逐步深入,研究发现多肽具有抗菌、抗氧化、抗肿瘤、免疫调节等作用。与传统药物相比,多肽类药物具有特异性强、分子量小、副作用小等优点,因此,多肽类药物已成为医药研发的新亮点[1]。 " {2 @2 E& b+ k7 ^7 ?3 A' z- N% C
海洋生物量占地球总生物量的87%,生物种类达20多万种,为开发生物活性肽提供了巨大的空间。自上世纪60年代以来,已从海洋生物中分离出近5000种化合物,这些化合物主要包括甾醇、萜类、生物碱、肽、多糖和蛋白质等。对天然活性多肽的研究主要集中在少数海洋生物,包括海葵、海藻、海绵和芋螺,藻类、鱼类、软体动物、甲壳类动物和水产加工副产物等[2]。从海洋生物中分离出来的许多种活性多肽中,只有一小部分会被作为食品或药品进行开发和销售,其中以鱼胶原蛋白肽、海参肽、牡蛎肽在市场中的应用最广、影响力最大。本文综述了近年来从海洋生物中提取活性多肽的方法以及各种多肽的生物活性,还对这些海洋多肽类产品的发展前景进行了展望,以期为海洋多肽在食品、药品领域的应用提供一定的参考。
& k) E4 k0 ?' R+ x( I 1 海洋多肽的提取方法
0 H ^3 o3 N' [0 l; O 海洋肽的生产与蛋白质来源、提取和纯化方法有关,采用合适的生产技术可以提高肽的产量和生物活性。目前已经用于生产海洋肽的技术包括化学水解、酶水解、微生物发酵和物理辅助提取。化学水解法因氨基酸受损严重、水解过程难控制而较少应用;酶水解法因具有生产条件温和,水解过程可控,肽得率高以及安全的优势,逐渐取代了传统的化学水解法,成为制备海洋生物活性肽的主要方法。
( L" J) J1 U( L7 J% h% [+ b; t 1.1 化学水解法
% r) h) Z5 q0 f9 N, r5 P 化学水解法采用酸或碱溶液水解肽键。酸水解一般使用0.02~0.03 mol/L的盐酸或硫酸在高温(121~138 ℃)、高压(220~310 MPa)下与蛋白质反应2~8 h,然后调节pH至6~7;而碱水解是在低温(27~54 ℃)下使用碱金属盐(如氢氧化钙、氢氧化钠或氢氧化钾)对蛋白质进行水解[3]。盐酸常用于海洋肽的酸水解。Wisuthiphaet等[4]使用盐酸(4 mol/L)水解鱼糜(100 ℃,90 min),结果显示水解度为50.7%时,谷氨酸的含量最高(16.3%),其次是天冬氨酸(10.4%)和赖氨酸(8.5%)。酸水解的影响因素的主次顺序为:水解温度>盐酸浓度>水解时间。一些其他类型的酸也已用于蛋白质水解,包括乙酸、硝酸、磷酸、马来酸和草酸,其产量受水解时间和温度控制[5]。 5 k6 N& ]0 d; G- m# e9 T
碱水解会破坏丝氨酸和苏氨酸从而导致产品功能性差,且反应过程中生成的氯丙醇有强致癌性;与碱水解相比,酸水解更为常用,然而酸水解的中和步骤会导致产品钠含量偏高和色氨酸的破坏。因此,虽然化学水解法操作简便、成本低,但在工业化生产蛋白肽中应用很少[6]。
& Y+ x2 @' h- s6 }8 } 1.2 酶水解法 / |! [% H6 |4 Z, R3 _5 F( o3 |
酶水解是在优化的温度和pH下,利用蛋白酶对蛋白质进行水解。由于不同的蛋白质可以被相应的酶水解,因此酶促水解容易控制且具有特异性,酶水解被广泛应用于蛋白肽的生产过程中[7]。蛋白酶种类的选择是生产小分子生物活性肽的关键,合适的蛋白酶包括动物蛋白酶(例如胃蛋白酶和胰蛋白酶)和植物蛋白酶(例如木瓜蛋白酶和菠萝蛋白酶)以及微生物蛋白酶(例如枯草芽孢杆菌蛋白酶和链霉菌蛋白酶)。由于动植物资源有限,工业生产中对蛋白质原料而言,枯草杆菌蛋白酶是生产小分子量生物活性肽的最佳选择[8]。
6 Z3 [* L) M# X) V1 B 由于各种酶的水解特性不同,多酶水解比单酶水解速率高且效果好,为改善海洋多肽的产品品质,现在一般采用复合蛋白酶水解法。邱娟等[9]用复合蛋白酶和碱性蛋白酶分步水解牡蛎肉,所得牡蛎肽中分子量在3000 Da以下的占99.72%。在酶促水解过程中,水解度的增加会降低产物肽的活性,这是因为随着酶解程度的增加,活性肽被分解为氨基酸或其中的活性基团遭到破坏。因此,在酶水解制备多肽时,应严格控制酶解度,在蛋白质被适度水解的条件下保证产物肽的高活性[10]。
; t' h8 M R8 ^( S: g; f, @' I 1.3 微生物发酵法 " O* m. R' y2 f# u" p. B
微生物代谢过程中产生的蛋白水解酶引起蛋白质水解,进而产生生物活性肽。细菌种类、蛋白质类型和发酵时间是决定水解率的重要因素[11]。例如,由于其高细胞外蛋白酶活性,干酪乳杆菌具有在牡蛎匀浆液中产生更多肽的能力[12]。闫泽文[13]分别使用酵母菌和乳酸菌发酵海参内脏酶解液,结果表明乳酸菌发酵可以大幅降低样品中的苦味肽含量,乳酸菌比酵母菌更适合用于海参内脏酶解液的发酵。江敏等[14]以1,1-二苯基-2-三硝基苯肼(DPPH)自由基清除率为指标,用枯草芽孢杆菌发酵马氏珠母贝,发现发酵时间对DPPH自由基清除率影响最大。此外,各种细菌或酵母菌的组合可以加速蛋白质的水解。
" ~* \8 ?6 s5 w5 \) B. f 发酵法生产活性肽具有成本低和产品适口性好的特点,但是发酵条件和水解程度不易控制,产物复杂,后续分离纯化困难,限制了其在工业生产中的应用。 . _3 Q. a* p4 v! F3 `% ]
1.4 物理辅助提取法
) A. @4 d& P9 F+ M0 `% A3 Q) Q. A1 N 超声波已被用于辅助肽提取,通常与酶水解相结合。在超声波的机械作用下,细胞发生微震荡,细胞内物质移动从而产生摩擦,细胞变软。适当时间的超声处理会使植物细胞壁破裂,细胞液释放到溶剂中,这些变化是物理变化,不会改变化学成分。李文欣等[15]以海参性腺为原料,利用超声波技术辅助中性蛋白酶水解制备血管紧张素转化酶(ACE)抑制肽,水解度和ACE抑制率分别可达到7.81%和73.81%。周燕芳等[16]利用超声波辅助酶解鲭鱼肉制备抗氧化肽,得到的多肽具有极强的抗氧化性,对DPPH自由基的清除率高达近90%。蓝尉冰等[17]使用超声波协同处理碱性蛋白酶酶解近江牡蛎,酶解液中氨基态氮的含量可达到26.13 mg/g。 : P8 d% M8 G* H1 A* P
超声提取可以显著缩短提取时间,提高提取效率,不需要高温改变肽的性质,因此生产出来的肽类具有很高的活性,在生产中得到了广泛应用。 6 {- Z% \' I* Q
2 海洋多肽的纯化方法 ' R1 i5 D- H8 j% ~7 D1 c
海洋多肽的活性与其分子量以及结构特征有关,小分子量组分(1~5000 Da)通常活性更高。蛋白水解液和发酵液是由不同种类、不同分子量的活性肽和非活性肽组成的复杂混合物,活性肽的浓度很低,因此,需要采用多种纯化方法来制备高浓度活性肽。常见的多肽分离纯化方法有色谱法和膜分离法。 * z6 \9 Y2 H; s
2.1 色谱法 % z: i* s8 V5 e1 s# o! _) P
色谱法的基本原理是在外力作用下使含有蛋白质的溶液流过含有各种填料的柱,由于不同蛋白质与色谱柱填料的相互作用不同,蛋白质在色谱柱中的保留时间也不同,因此可以根据不同蛋白质的保留时间对其进行分离纯化。通常,蛋白质的检测方法是将色谱柱的吸光度保持在280 nm。常用的色谱法可分为凝胶色谱法(SEC)、离子交换色谱法(IEC)、反相高效液相色谱法(RP-HPLC)等[18]。
3 P2 ~0 ]4 `# o& T( e+ V5 w7 e 根据柱内流动相的不同,SEC可分为凝胶过滤色谱(GFC)和凝胶渗透色谱(GPC)。以水为流动相的,称作GFC;以有机溶剂为流动相的,称作GPC。SEC的工作原理是根据蛋白质形状和大小不同,所以洗脱时间不同,大蛋白会通过凝胶珠之间的缝隙先被洗脱出来[19]。IEC是由Thompson等[20]首先发展起来的。IEC的基质由带电树脂或纤维素组成,根据离子交换剂的电荷,可分为阴离子交换色谱法(AEC)和阳离子交换色谱法(CEC),离子交换剂中的带电基团用于吸附溶液中带相反电荷的物质,然后进行洗脱分离[21]。离子交换色谱具有分辨率高、耐酸碱、操作简单等优点,已成为分离多肽的重要方法。 ' c/ n. }# ^7 U! j) ~
SEC操作简便,所需设备简单,分离介质可重复使用,分离效果较好,但分离操作较慢,而且对于分子量相差不多的物质难以达到很好的分离。IEC根据蛋白质表面电荷的差异对其进行分离,尽管分离量大,但分离出的样品纯度较低,通常用于初步分离。RP-HPLC分辨率高,广泛用于化学分析,具有快速、回收率高的特点,但是成本较高且操作复杂,样品处理量少,一般用于精细纯化,以量化小分子和离子以及分离和纯化大分子。蛋白质纯化通常需要多种色谱方法联用,一般先采用SEC或IEC将多肽粗分离后再利用RP-HPLC进一步纯化[22]。Kim等[23]采用GFC和RP-HPLC从海鞘蛋白水解物中分离并鉴定出了三种抗氧化肽组分(亮氨酸-谷氨酸-色氨酸(LEW),MW=446.2 Da;甲硫氨酸-苏氨酸-苏氨酸-色氨酸(MTTL),MW=464.2 Da;酪氨酸-酪氨酸-脯氨酸-酪氨酸-谷氨酰胺-亮氨酸(YYPYQL),MW=845.4 Da),其中,LEW因含有带负电的谷氨酸以及芳香族氨基酸色氨酸,对DPPH自由基的清除率活性最高(75%)。Bougatef等[24]使用AEC和RP-HPLC从沙丁鱼的粗酶提取物中分离抗氧化肽,结果表明,水解度为6%时水解产物的DPPH自由基清除活性最强(87%±2.1%,2 mg/mL)。 ' q/ a8 A# d9 N5 M, j' ]0 F
2.2 膜分离法 7 w4 z7 w" B9 k0 K
膜分离技术以浓度差或压力差作为驱动力,是应用于分离生物活性肽最广泛的方法[25]。膜分离工艺根据膜孔径大小分为四类:微滤、超滤、纳滤和反渗透。
+ l' F; y/ i0 q 微滤的分离原理一般认为属于机械筛分,膜的物理结构起决定性作用。微滤膜可分为有机膜和无机膜。有机膜包括醋酸纤维素、聚酰胺、聚碳酸酯和聚丙烯,无机膜包括陶瓷和金属。微滤膜的孔径为0.1~1 µm,因此,微滤膜可用于分离液体中的细菌和颗粒,以浓缩所需要的物质[26]。Nedzarek等[27]利用微滤技术处理腌制过鲱鱼的卤水,以分离卤水中的蛋白质和肽,处理过的卤水可以重复使用,减少了蛋白质的损失。
0 w% }$ f& y. D8 a9 l4 W$ w 与微滤分离过程相似,超滤也是通过膜孔的筛分作用将料液中大于膜孔的大分子溶质进行截留,使溶质与溶剂及小分子组分分离。超滤是介于微滤和纳滤之间的膜过滤过程,所用膜的孔径为1 nm~0.5 µm。超滤可用于净化、分离和浓缩溶液中的成分,超滤分离的典型分子量范围为10000~300000 Da。 5 q- q+ }) G- v2 Z
纳滤是在20世纪80年代后期开发的一种新型膜分离技术。纳滤膜截留分子量介于反渗透和超滤技术截留分子量之间的化合物,截留率>95%的纳滤膜截留的最小分子直径约为1 nm。纳滤膜的迁移机理尚未确定,目前大多数学者认为纳滤膜的分离主要是筛分效应和Donnan效应两种特征。纳滤膜可用于分离活性肽,肽分子含有游离羧基和氨基,在等电点上是电中性的,一些纳滤膜具有静电官能团,调节溶液的pH可以使这种纳滤膜捕获离子而不捕获电中性分子,具有相似分子量但不同等电点的肽可使用此类膜分离[28]。
1 Q" R( j( s1 q% T4 X( n/ b 反渗透是20世纪60年代初研制的利用压差的分离技术,当膜两侧的静压差大于溶液的渗透压时,溶剂分子将从溶质浓度高的溶液侧透过膜流向溶质浓度低的一侧。在海洋肽生产工艺中,反渗透技术主要被用于对肽溶液进行脱盐[29]。 # l1 G+ F2 T0 P2 h* E/ s9 ^+ y
采用膜技术分离生物活性肽具有快速、经济和环保的优点。然而,膜过滤技术也存在一些问题,如半透膜和疏水肽之间的相互作用、膜的污染和堵塞、难以获得纯肽以及样品需求量大等。为了解决这些问题,可以将膜过滤技术与色谱技术相结合,用于生产高纯度功能肽[30]。
" l/ ~& N1 q& E! b 3 海洋多肽的生物活性 " W7 C& |; p, ~/ l
3.1 血管紧张素转换酶 (ACE) 抑制活性 4 m$ `2 A$ }* R' _1 S
高血压是最常见的心血管疾病之一[31]。血管紧张素转换酶(ACE)是肾素-血管紧张素系统(RAS)中的关键酶,在调节血压方面起着至关重要的作用[32]。ACE可以使缓激肽(激肽释放酶——激肽系统中的一种降压肽)降解,引起血压升高;另外,还能将无活性的血管紧张素I,转化为有效的血管收缩剂血管紧张素II,血管紧张素II还能刺激肾上腺皮质合成和释放醛固酮,导致血压升高。
2 }, K V/ G! Y- V/ g! M 高血压治疗的有效方法之一是抑制ACE的活性[33],ACE抑制剂阻断血管紧张素I转化为血管紧张素II,导致血管松弛和血压下降[34]。目前已有药企合成了各种ACE抑制剂用于治疗高血压,但这些药物具有不良副作用,需要开发天然食物来源的ACE抑制剂来控制高血压[35]。肽对ACE活性的抑制能力主要取决于C端氨基酸,C端含有芳香族氨基酸(Trp、Phe和Tyr)或疏水氨基酸残基,N端为脂肪族氨基酸(Val、Ile和Leu)的多肽具有较强的ACE抑制活性。与合成药物相比,从食品蛋白质中获得的肽更安全且易被吸收,目前已从许多海洋生物的蛋白质水解物中分离出具有ACE抑制活性的肽,主要为贝类(牡蛎[36-37]、贻贝[38]、杂色蛤[39])、沙丁鱼[40]、紫菜[41]等降血压肽。具有ACE抑制活性的海洋多肽来源及其作用效果如表1所示。 9 k2 D- Y$ a# ~' z
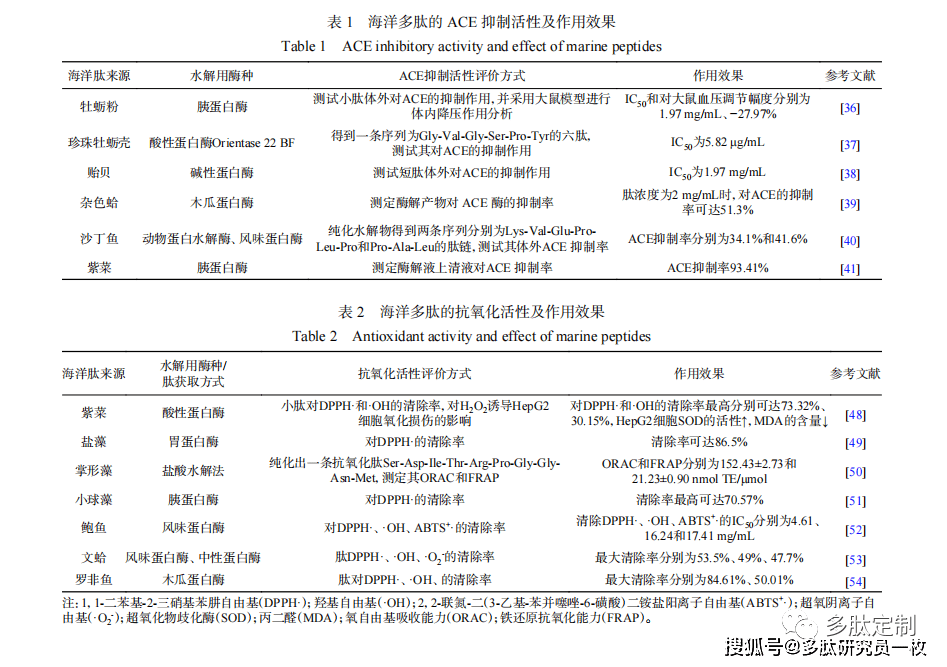
9 w5 D, L2 H5 ? 肽的结构对其ACE抑制活性有重要作用,链长、氨基酸组成和序列是ACE抑制肽的主要特征。ACE抑制肽通常是含有2~12个氨基酸的短链肽,结晶学研究表明大肽不能与ACE的活性位点结合。然而,长链肽在某些情况下可能具有ACE抑制活性,因为氨基酸组成可能比肽的长度更重要。这可能与氨基酸类型有关,因为含有酸性氨基酸(Asp和Glu)的肽具有螯合锌原子的净负电荷,而锌原子是维持ACE活性的必需成分[42]。ACE抑制肽的C端和/或N端由特定氨基酸残基组成,C端含有芳香族氨基酸(Tyr、Phe、Trp、Pro),N端包含脂肪族氨基酸(Val、Ile、Lys、Arg和Leu)[43]。对长链肽而言,ACE抑制作用与C端氨基酸有关[44]。 4 q2 U! Y# s& U
3.2 抗氧化活性
4 p2 b! z4 p" e) E 自由基介导的脂质氧化、氧化应激和抗氧化剂是当前许多研究领域广泛关注的问题。许多疾病与自由基攻击膜脂、蛋白质和DNA有关,如糖尿病、癌症、神经退行性疾病和炎症[45-46]。此外,食品中脂质的氧化和过氧化会导致食品变质。许多合成抗氧化剂,如丁基羟基苯甲醚(BHA)和丁基羟基甲苯(BHT)被用作食品添加剂,以防止变质。这些合成抗氧化剂比天然抗氧化剂(如α-生育酚和抗坏血酸)具有更强的抗氧化活性,但由于其具有细胞毒性和DNA损伤作用,这些化合物的使用已开始受到限制[47,24]。因此,能够用于食品和医药材料的天然来源的抗氧化剂化合物引起了人们的广泛关注。研究表明,食物来源的蛋白质水解物除了具有营养特性外,还具有抗氧化功能,这些功能与生物活性肽有关,目前海洋类抗氧化肽的来源主要为藻类(紫菜[48]、盐藻[49]、掌形藻[50]、小球藻[51])、贝类(鲍鱼[52]、文蛤[53])以及罗非鱼[54]。具有抗氧化活性的海洋多肽来源及其作用效果如表2所示。 9 M- D- U1 m. r5 i f& J. f' \" L6 L
到目前为止,抗氧化肽的构效关系仍不明确。一般认为分子量大小,特别是在500~3000 Da范围内,是影响蛋白质水解物抗氧化活性的关键因素,较小的分子量以及序列中的疏水和/或芳香氨基酸可能有助于增强多肽的抗氧化活性[55-56]。肽的结构(氨基酸序列)与其活性之间也有重要联系,多肽N端位置含有的疏水性氨基酸可以提高其抗氧化能力[57];含有组氨酸的多肽具有很强的抗氧化活性,这可能与咪唑环的螯合和捕获自由基的能力有关。 , e3 F+ s( {( p4 k# K( K
3.3 抗肿瘤活性 * w/ s$ N I. ?7 ^/ p
癌症是由正常细胞异常增殖引起的疾病,通常表现为细胞生长失控,最终损害正常细胞功能。海洋肽通过诱导癌细胞凋亡、下调PI3K/Akt信号通路、抑制癌细胞增殖和促进血管生成而具有显著的抗癌活性[58]。与药物相比,海洋多肽分子量小、易被吸收、特异性强,近几年在癌症治疗方面备受关注。从海洋生物中提取的抗癌肽大都是富含D-氨基酸、α-氨基酸、β-氨基酸、羧酸和噻吩的小环肽,有些还含有烯键和炔键,这大大提高了肽的稳定性和生物利用度[2]。海洋类抗肿瘤肽的来源主要为藻类(螺旋藻[59]、紫菜[60])、贝类(杂色蛤[61]、牡蛎[62])和海绵[63]。具有抗肿瘤活性的海洋多肽来源及其作用效果如表3所示。 - W5 \/ b; y/ L5 T* T

2 ~ I" | a6 |4 o8 z5 N) D9 @
与健康细胞相比,癌细胞通常含有更多的微绒毛,从而使细胞表面积增大,这种特性可以促进抗肿瘤肽与癌细胞结合。因此,抗肿瘤肽与细胞膜组分之间的静电相互作用被认为是这些肽选择性杀伤癌细胞的主要原因。除了理化性质外,肽的二级结构对于细胞表面相互作用(包括肽结构取向)也是必不可少的。肽的取向可以增强与癌细胞膜靶向相互作用的表面活性,相互作用的角度导致癌细胞膜上脂质堆积不稳定,从而导致膜渗透[64-65]。
$ l3 {: T$ s5 c; T& F8 \& N6 |+ q 近年来在海洋生物中发现了近百种具有抗肿瘤作用的海洋多肽,其中90%的多肽是通过诱导细胞凋亡发挥抗肿瘤活性的[66]。脱氢膜海鞘素B(Dehydrodidemnin B)为脂肽类环状缩肽,通过靶向细胞凋亡机制发挥抗肿瘤作用,在低浓度时(0.01% μg/mL)对乳腺癌、卵巢癌、肾癌及肉瘤等均有明显活性,其免疫抑制活性与目前临床上常用的免疫抑制剂类固醇激素相比要高出100~1000倍[67]。海洋多肽的来源是困扰多肽药物发展的主要问题,许多海洋多肽只能从一种物种中获得。例如,Dehydrodidemnin B只能从膜海鞘(Trididemnum solidum)中提取到[68]。多肽药物比小分子化药结构复杂,合成成本较高,需要开发合适的化学合成技术解决多肽药物来源困难的问题。 % c9 b6 j9 G2 W
3.4 其他生物活性 ( n# c/ e T7 G
从不同海洋生物中分离的肽结构多样,因此具有多种功能活性。Hajfathalian等[69]的研究强调了不同来源的海洋多肽通过不同机制具有抗遗传毒性/抗突变、抗贫血、抗肥胖、免疫调节和细胞调节的潜力。Fan等[70]评估了从螺旋藻中获得的肽的抗肥胖作用,结果表明四种肽(NALKCCHSCPA、LNPSVCDCMMKAAR、NPVWKRK和CANPHELPNK)均对脂肪细胞增殖具有显著的抑制作用(32.3%~60.1%)。陶雅浩等[71]发现牡蛎肽可以提高小鼠的运动耐力,增强蛋白质分解供能能力,减少运动过程中对骨骼肌的损伤。在另一项研究中,Narayanasamy等[72]证明了从海蟹腿部肌肉中分离的肽(LGLGLGAAVL,MW713.5 Da)在脂多糖诱导的RAW 264.7巨噬细胞中对COX-2的抗炎活性。
3 }3 l- Z$ C1 w* l( W, a) U2 T 4 结语
' R( Z2 O' @4 _% V2 r 海洋活性肽具有药理稳定性、强效性、特异性和高度安全性的特点,对防治癌症、艾滋病、心脑血管病、老年病等疑难病症具有独特效果,已成为开发新药、特药的主要方向之一。人体必需的氨基酸都可以从海洋生物中提取,而海洋生物中的氨基酸资源极其丰富。海洋活性肽结构独特,许多化合物具有在陆地上从未发现过的新型骨架结构。然而,到目前为止,关于从海洋生物中分离具有高产量和生物活性的新肽的研究还很有限。开发基于纳米技术的新技术,将海洋肽封装在各种纳米结构中,如纳米乳液、纳米脂质体和聚合物纳米颗粒,以增强其体内稳定性和生物利用度尤为重要。海洋肽的研究方向应侧重于寻求具有更高选择性和分辨率的分离、纯化技术,以获取高收率、低成本的新型肽。此外,应加强海洋多肽在人类临床试验方面的应用,以开发多肽类药物和功能性食品。 7 n4 u4 H& e* V# I
免责声明:本文为行业交流学习,版权归原作者所有,如有侵权,可删除返回搜狐,查看更多
- p1 C" l. {1 h* G) [. J/ \, N8 N/ X3 f4 G
责任编辑:
: g3 t- {1 k/ i* e9 h! Z7 q+ q3 q: _6 L1 k4 S+ Z h" G" g
) ^; w! w( X+ h! i
/ E1 ^1 ]+ J1 \, r5 `; ~$ Y, A2 |! `! `& v% A: A! _8 V
| 

