|
- b3 ]. S5 M$ U6 S 原标题:科研丨复旦: 季节性变化驱动水生根际微生物群落结构和功能特性的变化(国人佳作) - W6 s6 H z& ]( c
' I) r. i6 R3 G; i- H( ]% W' X0 X
作者:微生态
9 `$ ^0 c5 D- E! l4 o+ ^' L: E. K 编译:微科盟XY,编辑:微科盟居居、江舜尧。
+ N# n; N9 i; p2 e: A9 C& O 微科盟原创微文,欢迎转发转载,转载须注明来源《微生态》公众号。
2 x5 f/ w4 P Y! p8 F5 U 导读
/ F6 E. I: f8 T( d( o 生态浮床可以使根系悬浮,这使得水下的根系可以成为各种微生物的港湾。但对微生物群落结构变化及其影响机制尚缺乏系统的研究。本研究采用选定的植物[风车草(Cyp)、水竹芋(Tha)和鸢尾(Iri)]构建生态浮床,并与对照组[静水(S)]进行比较。结果表明,秋季根际微生物群落丰度和多样性最高,优势类群为变形菌门、放线菌门、蓝藻门、绿弯菌门、厚壁菌门、拟杆菌门和酸杆菌门。Tha组和Cyp组的微生物群落有很大的重叠,而Iri组和对照组则表现出明显的多样性。同一植物的根系微生物种群在不同季节也会有较大的变化。相反的,光合自养生物和专性厌氧生物更倾向于在较高温度和较低溶解氧(DO)浓度下生长,并且会逐渐成为优势种。Tha组和对照组的微生物共现网络复杂,既有合作也有竞争。此外,TOC是塑造微生物群落结构的重要环境因素,而DO通过影响好氧和厌氧细菌的丰度来改变微生物群落。具有低/无相应代谢途径的微生物显示出降解和代谢非食用物质的潜力。
3 n( L( r t; g/ i 论文ID ( K; g. b6 }0 {, w$ v3 W
原名:Seasonal changes driving shifts of aquatic rhizosphere microbial community structure and the functional properties . v# N b2 `1 C% q
译名:季节性变化驱动水生根际微生物群落结构和功能特性的变化
8 G, u3 ?/ V# s# a 期刊:Journal of Environmental Management 9 S' k/ N. G2 [; d8 ?' \8 N6 V
IF:8.91
) i4 C; l4 \( O 发表时间:2022.9 * G4 T# {2 a* A3 A4 m1 E5 k- K
通讯作者:张继彪
" e# F- A7 E" H 通讯作者单位:复旦大学环境科学与工程系 , W* T Y+ P; e' ^4 H+ S) v8 n
DOI号:10.1016/j.jenvman.2022.116124 ! \4 P% ^( L( ^) b8 c+ H* `- h
实验设计 ( \! M) C4 U7 W o2 B

7 m" P9 G! U# M! L) V
结果与讨论 : x9 y3 t3 r9 x7 d5 O) u3 |
1.水质结果 / K- @ t7 I, n) L H) W
样品的物理化学性质因季节和植物类型而异。DO水平在春季最高,Tha_2和Iri_2达到12.17 mg L−1和10.21 mg L−1。这可能是由于它们旺盛的水下根系的寻氧活动。相反,S_3、Iri_3和Tha_3以及Cyp_3的DO浓度在秋季下降(7.39-8.77 mg L−1)。这表明,较低的DO浓度可能会抑制好氧细菌的繁殖,增加厌氧细菌的丰度,最终改变微生物群落的组成。TP在秋季和冬季达到最高值0.23 mg L−1(Cyp_1)和0.22 mg L−1(S_4),但在夏季下降至0.08 mg L−1(S_2)。全氮与全磷呈相似趋势,在冬季增加至3.85 mg L−1(Cyp_1),但在夏季下降至1.19 mg L−1(Tha_3)。这些结果表明,宛山荡水体富营养化程度较高。在春季和夏季,由于水中的植物需要更多的氮和磷进行自养代谢以维持自身的生长和繁殖,水体富营养化程度降低。此外,TOC在秋季达到最佳水平,S_4组显示11.31 mg L−1。产生这些结果的一个可能原因是秋季水体中的微生物多样性和活性高,以及微生物之间物质的频繁交换。相反,冬季和春季的TOC水平较低,降至5.11 mg L−1(Iri_1)和5.89 mg L−1(S_2),这可能反映出冬季和春季微生物的多样性和代谢活性降低。在Mu等人的研究中,温度的变化影响了微生物群落的α多样性和组成,从而抑制了水体中TN、TP和COD浓度的降低,这与本研究的结果一致。 2 f# h u( c) T9 C r
2.水生根际微生物群落组成
. n# Z8 a8 O+ E 不同EFB(Ecological floating beds,生态浮床)植物的微生物群落组成如图1所示。对照组共获得1417个独特的OTU,而试验组的OTU介于369和1131之间(图1a)。各实验组之间共享了高百分比(15.0%–18.3%)的OTU,这表明核心微生物群相当小,EFB和植物之间的空间异质性较低。对于实验组,与Iri和Cyp组相比,Tha组具有更独特的OTU,这可以通过植物(水竹芋)的额外营养供应来解释。根据季节分组数据,秋季分配了大量独特OTU(2400个),而春季、夏季和冬季分别由427、285和274个独特OTU组成(图1b)。秋季OTU数量高可能是由于该季节降雨量高,加上植物代谢速率加快,以及与根微生物的频繁养分交换所致。这些结果与α-多样性分析一致。
- g5 S/ D- T+ q9 F& N5 m" s) x 样品中优势门的分类组成如图1c所示。微生物种群在门水平上相对相似,但丰度不同。主要的群落成员包括变形菌门(18.2%–51.8%)、放线菌门(5.73%–29.3%)、蓝藻门(0.318%–51.8%)、绿弯菌门(0.543%–27.7%)、厚壁菌门(0.262%–39.9%)、拟杆菌门(1.47%–21.7%)和酸杆菌门(0.228%–12.1%)。变形菌门和拟杆菌门是常见的淡水类群,但也是EFB的主要类群。已知这两类物种可代谢复杂的有机分子,它们的优势意味着在浮床中具有类似的能力。此外,蓝藻在富含氮和磷的水体中生长旺盛,经常被用作富营养化的指标。总体而言,这些分类群的优势表明浮床存在一定程度的富营养化和/或营养富集。尽管富营养化水平随季节波动,但水质数据证实了高TN和TP浓度与富营养化时间一致。这可能与不同季节优势门微生物丰度的差异有关。图1d显示了实验组和对照组之间在分类学组成上的重要差异,其中包括:(i)植物根中的硝化螺旋菌属(Nitrospira)和假红杆菌属(Pseudorhodobacter)(α-变形菌)的丰度高于湿地水体。硝化螺旋菌通过将氨和亚硝酸盐转化为硝酸盐在水生氮循环中发挥重要作用,并最终防止氨和亚硝酸盐的积累。此外,还检测到反硝化菌,如芽孢杆菌(Bacillus),并显示出与硝化螺旋菌属和假红杆菌属相似的富集趋势。(ii)主要在对照组中检测到Limnohabitans(变形菌门),并且在植物根中的丰度极低(Tha、Cyp和Iri)。尽管我们的结果与之前的研究相矛盾,在根界面选择特定的Limnohabitans物种和/或菌株的过程往往有利于水体中的某些微生物。冬季的低TOC水平与春季的高TOC水平可以解释我们的结果。(iii)乳球菌属(Lactococcus)是一种单性厌氧微生物,营养需求复杂,夏季比秋季生长更旺盛。较低的DO浓度和较高的水温可能会导致其在较暖月份的丰度显著增加。 ' E7 {! N& ~' j, K) z
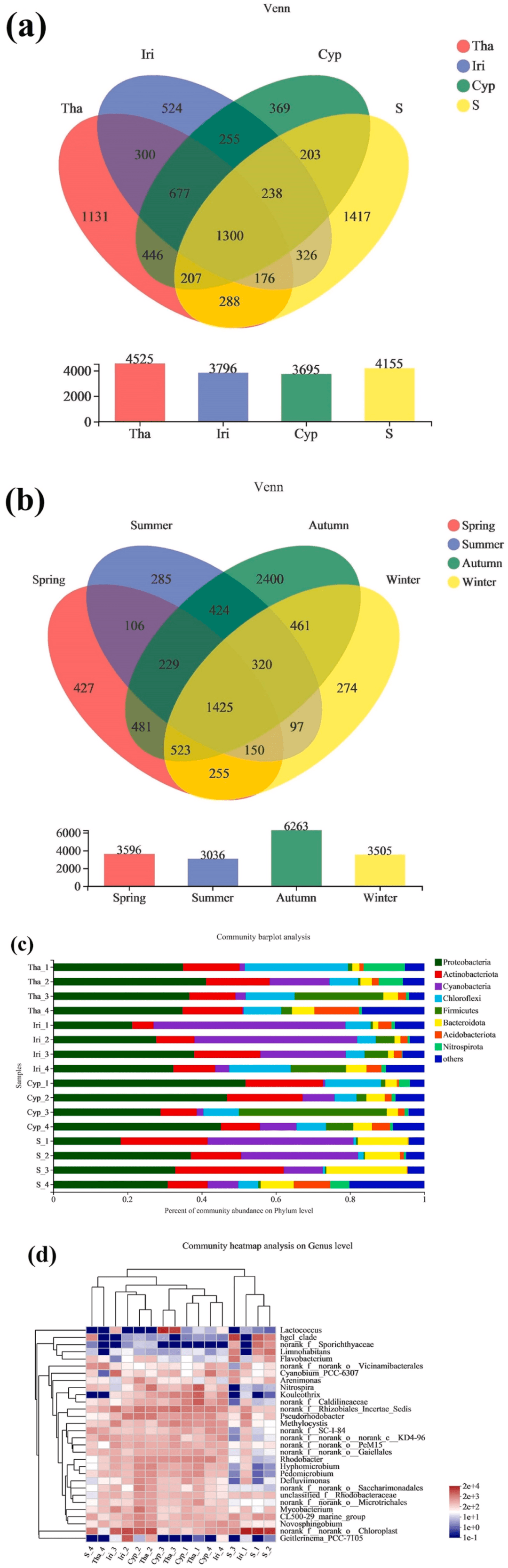
1 ^6 v# ~0 K3 s 图1. 不同浮床挺水植物的根系微生物种类组成: % i) ?. K; \7 \* m0 ?% Q8 n2 K, O
(a)不同挺水植物微生物组成的相似性和重叠的维恩图;(b)不同季节微生物组成相似性和重叠的维恩图;(c)门水平不同挺水植物根微生物组成的条形图;(d)属水平群落组成相似性与差异性的热图。
4 R5 T( L4 [+ o& t% |7 [& j 3.水生根际微生物群落的α多样性
! R d9 c1 ~* W! ?: Y8 H( B) y 与其他季节相比,秋季的丰富度估计值(Shannon:3.802–6.726;Chao1:905–3874)显著较高(P<0.05)。Cyp_4、Iri_4,Tha_4和S_4(秋季)的Chao1值异常高,而Cyp_3、Iri_3、Tha_2和S_4(总和)的Chao1值降低,因此反映了较低的微生物丰度。后者可能归因于夏季期间进水口流量受到限制,导致水位较低。此外,较高的温度可能导致水体中需氧细菌的数量减少。对照组的Chao1指数显示出与实验组相似的趋势,表明出现的水生植物不是影响微生物多样性和丰度的关键因素。与其他组(Cyp_4、Iri_4,Tha_4和S_4)相比,实验组Cyp_1、Cyp_3、Iri_1、Tha_1、Tha_3、S_1和S_3(冬季和夏季)的Shannon指数显示出较低的物种多样性,这意味着微生物群落在冬季和夏季可能都受到温度的严重影响。高覆盖指数意味着通常被测量的高概率。Wilcoxon秩和检验证实了不同类型浮床和植物之间微生物丰富度的差异不显著,验证了挺水植物/水生植物类型在微生物丰富性中不起作用。
& z8 X" C% S5 p( {6 A# g$ \ 4.水生根际微生物群落的β多样性
4 R# E8 V g$ A7 O! B 不同挺水植物之间的微生物群落组成差异显著(p=0.013)(图2a),这也得到了Adonis的证实。Tha和Cyp群落高度重叠,而Iri和对照组呈现出明显的多样性群落,可能是由于根系的寻氧能力和植物的常绿特性不同所致。此外,不同类型植物构建的浮床导致影响微生物群落结构的水体发生变化。例如,Iri根微环境中的TOC含量在一年中波动很大,而TP含量在一年间保持相对稳定。这些变化/波动可能导致特定微生物群落的聚集。 + _0 i8 I0 x p4 |( z
尽管在较冷的月份(秋季和冬季)观察到了一定程度的异质性,但群落结构在季节之间变化不大(图2b)。这种现象可能与较低水温对微生物生存和功能的影响有关。相反,光合自养生物和专性厌氧生物更倾向于在较高温度和较低DO浓度(即春季和夏季)下茁壮成长,逐渐发展为优势物种。
8 T3 v7 m' w& t" m. q8 U* W' S( l 基于属水平的微生物群落差异通过单因素方差分析进行评估(图3)。与对照组相比,实验组(Tha、Cyp和Iri)的Rhizobiales Incertae Sedis(根瘤菌科)和红杆菌属Rhodobacter(红杆菌科)的丰度显著(P<0.05)更高。Rhizobiales Incertae Sedis可利用广泛的碳水化合物,也可以与豆科植物根际建立共生关系以固氮。因此,我们推断,实验组中的高丰度以及较高的营养水平与植物根系中的共生固氮有关。红杆菌是一种重要的光自养生物,可以利用水生根系微环境中存在的硫化氢和/或硫代硫酸钠进行生长,从而增加其在植物根系中的丰度。相比之下,与实验组相比,对照组中CL500-29-marine-group和hgcI-clade(蓝藻)的丰度显著更高。这并不奇怪,因为之前的研究表明,蓝藻是宛山荡太湖全年的主要分类群,偶尔会在夏季发生爆发的现象。
9 i$ P( B, U+ J3 \( ~7 s1 f1 \ 图S3显示了所有样品中微生物群落的层次聚类树。结果表明,Tha和Cyp组在相应季节具有相似的物种组成,表明根微环境具有高度相似性。相反,对照组和Iri组单独聚集,这表明两组具有独特的微环境。
3 }8 V# p' H# ^+ d, w/ C, h8 p 
" N* T: Z. `3 r% S1 X) x4 V- `9 d
图2. OTU层面的主坐标分析(PCoA)。 ?' z6 e: F+ R. @; o5 J) ]
不同颜色的圆圈代表不同的分组方法:(a)以不同植物作为分组标准的PCoA分析;(b)以不同季节作为分组标准的PCoA分析。
* V8 U2 |, w9 M4 m 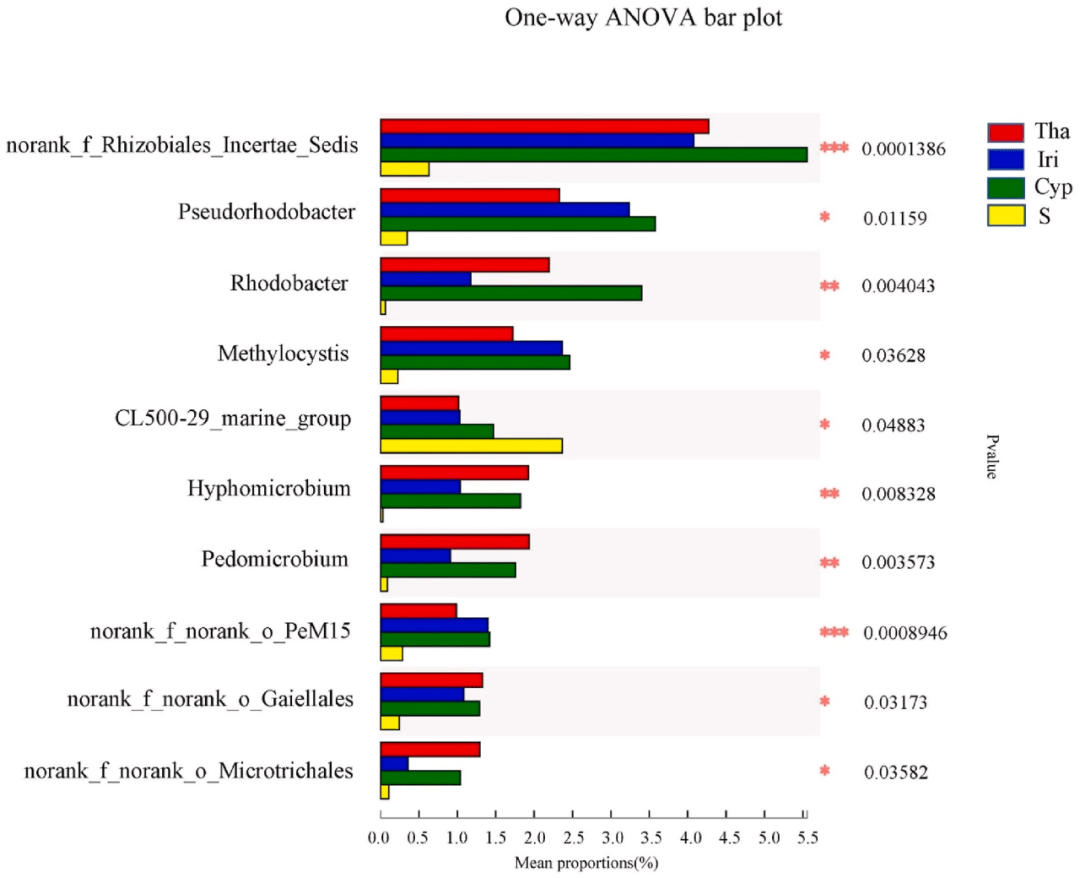
3 t1 b4 N' R$ [( b$ t1 m. v0 B
图3. Tha、Iri、Cyp和S组之间差异的显著性检验。 1 w2 x/ b: l; @3 B0 G8 w7 h
Y轴表示某一分类水平上的物种名称,X轴表示不同物种组的平均相对丰度,不同颜色的条表示不同的组;最右边是P值,* 0.01 < P ≤ 0.05, ** 0.001< P ≤ 0.01, *** P ≤ 0.001。
# _+ i/ i" `' E4 K* h& j4 J8 A9 Z9 _$ X 5.环境因素对微生物多样性的影响 % i+ t9 c, L4 E' z; V$ K( O
环境因素在RDA图的第一轴上解释了11.3%,在第二轴上解释了20.43%。(图4)。微生物群落主要受TOC(R2=0.9426)、TP(0.2679)、TN(0.153)和DO(0.0562)的影响。皮尔逊相关性证实,TOC对微生物群落的分布有显著影响(p=0.001)。TOC对群落的巨大影响可归因于污染物通过城市污水(促进富营养化)和/或初秋降水流入。如果湿地长期处于富营养化状态,TOC含量的变化将最终影响微生物群落组成。 1 D3 c9 j* l& y! B$ O

" C9 ~' o8 m% a) r1 E8 I, @, A6 N 图4. 环境因子(TP、TN、DO、TOC)与(a)预测代谢基因家族组成之间关系的冗余分析(RDA)。第一和第二轴上的百分比表示RDA对变异的解释。
# W1 ~& S; f7 c r( |: {4 s) ] 6.共现网络
9 m% s) r4 e/ e" g 网络分析用于证明不同实验组(Tha、Cyp和Ira)和对照组的OTU之间的共现(图5)。对于Tha网络(图5a),生丝微菌科(Hyphomicrobiaceae)和红杆菌科(Rhodobacteraceae)被认为是优势物种,占所有节点的23.4%。这两个分类群的代谢多样,策略范围从光合作用到有机物分解。生丝微菌科和红杆菌科与其他OTU的关系既合作又竞争。同样,红杆菌科是Cyp网络中的一个重要分类单元,占节点的14.6%(图5b)。红杆菌科与其他OTU正相关,即推断出合作关系。我们认为,水竹芋(Tha)和风车草(Cyp)的根系分泌的有机物质适合各种微生物群的生长和繁殖,如反硝化细菌、聚磷酸盐累积生物(PAOs)和其他异养细菌。
) w* @6 U. X5 ?; m; _1 [3 k 在Iri网络中确定的优势菌为Phormidiaceae(蓝藻门),占所有节点的16.7%(图5c)。Phormidiaceae和其他OTU之间的大多数相互作用主要是正向的,这可能表明生态位重叠和共代谢。最后,对于S组(图5d),鱼孢菌科Sporichthyacea(放线菌门)作为优势类群,与其他OTU表现出强烈的正相关和负相关。总体而言,OTU之间的共现受植物类型和微环境的影响,预测关系由正(即生态位重叠、共代谢)和负(即竞争、非重叠生态位或无营养状态)影响产生。这表明,除不同细菌的合作外,Tha和S组中存在更大的生态位重叠和功能冗余。这一结果与之前的研究结果一致,细菌的生态位重叠可导致积极的相互作用,可能由不同的细菌群引起。 ' t6 Y! Z1 L y. S A. Q
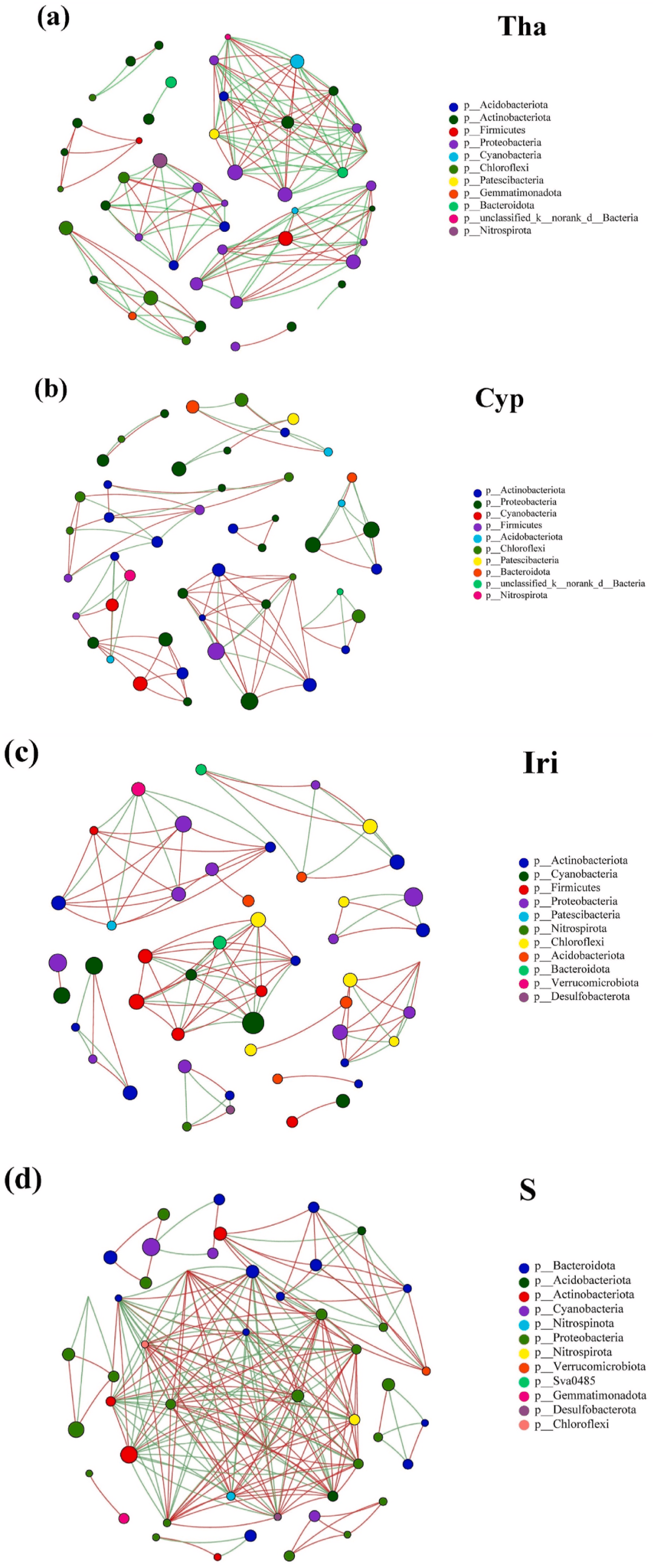
3 ?+ E& k# ]% E+ K 图5. Tha(a)、Cyp(b)、Iri(c)和S(d)组中附生生物膜微生物群落的共现网络。
M& h0 f- u9 w$ @% i! F9 U4 B 网络中的节点根据不同的门着色。选择科水平总丰度排名前50的物种,并根据不同的门对网络节点进行着色。图中默认显示p < 0.05的物种;图中节点的大小表示物种丰度大小,不同颜色表示不同物种。连接表明存在强而显著的(FDR-corrected P-values < 0.05)相关性,分为正(Pearson’s ρ > 0.6;红色)或负(Pearson’s ρ < -0.6;绿色)边。
. {4 c- z% {0 I 7.水生根际微生物功能预测 2 J4 d8 M4 O, h' B! t0 j
水生根际微生物群落的潜在功能如图6a所示。值得注意的是,DNA指导的DNA聚合酶、NADH:泛醌还原酶(H(+)-translocation、DNA解旋酶和组氨酸激酶的基因丰度显著增加(P < 0.05)。这表明微生物在细胞生殖代谢、光合作用、碳水化合物代谢、生物降解和异型生物量代谢以及氨基酸代谢方面更为活跃。Iri组、Cyp组和S组中3-氧酰基-(酰基-载体-蛋白)还原酶和非特异性丝氨酸/苏氨酸蛋白激酶的基因丰度较低。结果表明,这些组的细胞增殖、凋亡、细胞分化和脂肪酸生物合成的调节活性降低。然而,基因丰度和活性降低的原因还有待进一步研究。 ; N3 }2 ~" E: H
使用季节作为分类标准,DNA指导的DNA聚合酶、NADH:泛醌还原酶(H(+)-translocation、DNA解旋酶和组氨酸激酶的基因丰度显著较高。这表明季节性变化并没有改变微生物基因的主导地位。结合图6b中的FAPROTAX功能预测,许多基因丰度与海洋和湖泊生物地球化学有关,如硫、氮、氢和碳循环。这可能会在异养微生物和自养微生物之间创造一个竞争性的营养环境。植物根际有效氧和碳的释放对于促进铵氧化和固氮至关重要,并可能进一步介导湿地氮循环。
8 L+ Q4 W* X9 g' M# x8 S: q1 G* \" Z8 B$ I( ~. X
图6. 基于PICRUSt(a)和FAPROTAX(b)的功能群落概况的热图。
% `: X2 \9 X. s$ m+ f 结论 7 W0 b R% Z. {, C5 A3 i, u: P
本研究结果表明,不同挺水植物的水生根际微生物群落存在显著差异。在同一季节,Tha组和Cyp组群落之间存在显著重叠,而Iri组和对照组显示出显著多样的群落。微生物共现网络显示,Tha组和S组微生物群落间呈正相关和负相关关系,而Cyp组和Iri组之间正相关关系占优势。对于同一植物,秋季的微生物多样性和丰度也高于其他季节。TOC对微生物群落组成有显著影响,DO通过影响好氧和厌氧细菌的丰度改变微生物群落。潜在功能包括细胞生殖代谢、光合作用、碳水化合物代谢、芳香化合物的生物降解和代谢以及氨基酸代谢。因此,种植水竹芋并调节TOC和DO浓度有助于提高生态浮床(EFBs)中根系微生物群落的多样性和稳定性。
$ e1 L3 s2 T' B- U l5 g 本文转载自其他网站,不代表健康界观点和立场。如有内容和图片的著作权异议,请及时联系我们(邮箱:guikequan@hmkx.cn)返回搜狐,查看更多
) a2 l7 w7 T0 B- _+ M7 W6 f5 y, N1 n" H- g
责任编辑: ! J4 d' u0 y, i* Z7 }
1 v) t; o1 D7 f' N* W! Y) x# V: g2 K" U
! d1 S2 w% U6 A, ?! C
+ y {* j- p& E: E1 g9 J/ p# d | 

